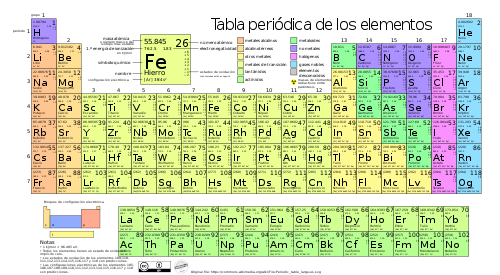
LA TABLA PERIÓDICA
OBJETIVO :
Repaso de la tabla periódica, para que los estudiantes de grado noveno puedan hacer una correcta interpretación de esta, al momento de nombrar compuestos inorgánicos
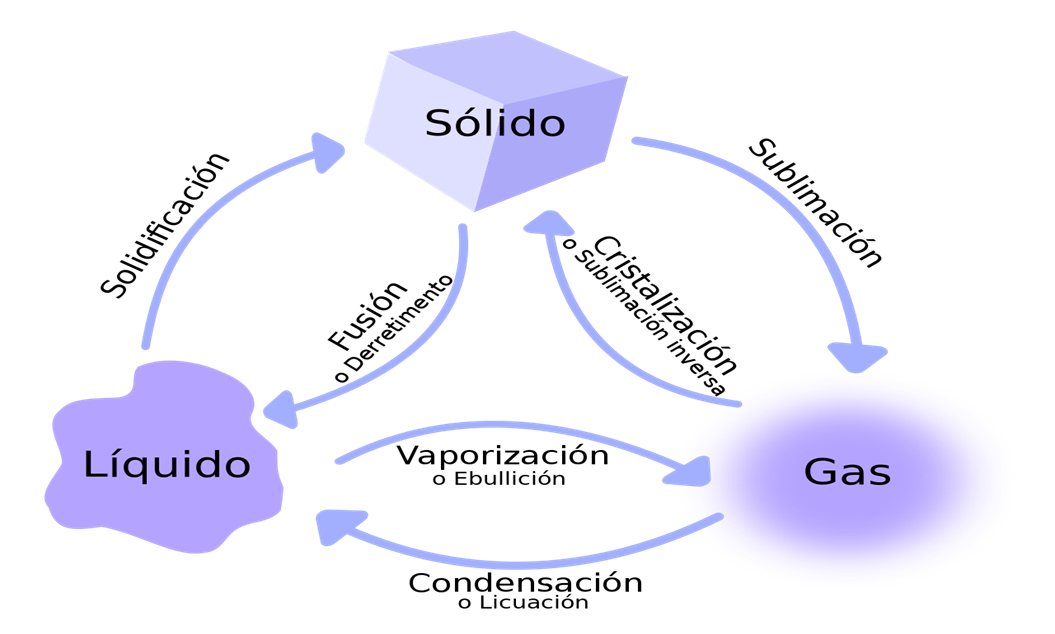
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna(ley periódica)
Las filas de la tabla se denominan períodos y están indicadas con números arábigos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.

Dimitri Mendeléyev publicó en 1869 la primera versión de la tabla periódica que fue ampliamente reconocida. La desarrolló para ilustrar tendencias periódicas en las propiedades de los elementos entonces conocidos, al ordenar los elementos basándose en sus propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. Mendeléyev también pronosticó algunas propiedades de elementos entonces desconocidos que anticipó que ocuparían los lugares vacíos en su tabla. Posteriormente se demostró que la mayoría de sus predicciones eran correctas cuando se descubrieron los elementos en cuestión.

Se han descubierto o sintetizado todos los elementos de número atómico del 1 (hidrógeno) al 118 (oganesón); la IUPAC ( unión internacional de la química pura y aplicada y es la autoridad reconocida en el desarrollo de estándares para denominación de compuestos químicos)confirmó los elementos 113, 115, 117 y 118 el 30 de diciembre de 2015, y sus nombres y símbolos oficiales se hicieron públicos el 28 de noviembre de 2016. Los primeros 94 existen naturalmente, aunque algunos solo se han encontrado en cantidades pequeñas y fueron sintetizados en laboratorio antes de ser encontrados en la naturaleza.. Los elementos con números atómicos del 95 al 118 solo han sido sintetizados en laboratorios. Allí también se produjeron numerosos radioisótopo(
es un átomo que tiene un exceso de energía nuclear) sintéticos de elementos presentes en la naturaleza. Los elementos del 95 a 100 existieron en la naturaleza en tiempos pasados pero actualmente no.La investigación para encontrar por síntesis nuevos elementos de números atómicos más altos continúa.
NOMBRES DE LOS GRUPOS DE LOS ELEMENTOS QUÍMICOS
INFORMACIÓN DE LA TABLA PERIÓDICA
EJERCICIOS
1.Indicar los símbolos de los siguientes elementos: buscamos en la tabla periódica cada nombre y miramos su símbolo, lo anotamos, tener en cuenta la ortografía;mayúsculas y minúsculas
- Cálcio
- Neón
- Aluminio
- Mercurio
- Oro
- Plata
- Níquel
- Radio
- Fósforo
- Nitrógeno
- Azufre
- Potasio
- Magnesio
- Litio
- Arsénico
- Bromo
- Cinc
- Hierro
- Cloro
- Estaño
- Helio
Solución
- Calcio: Ca
- Neón: Ne
- Aluminio: Al
- Mercurio: Hg
- Oro: Au
- Plata: Ag
- Níquel: Ni
- Radio: Ra
- Fósforo: P
- Nitrógeno: N
- Azufre: S
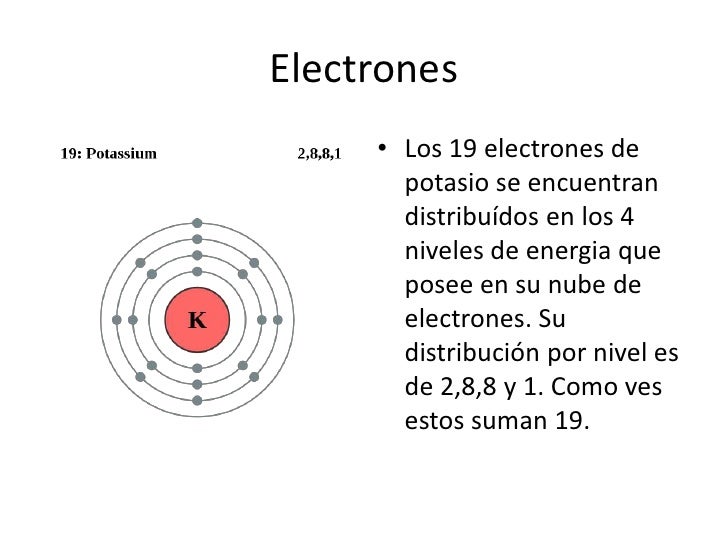
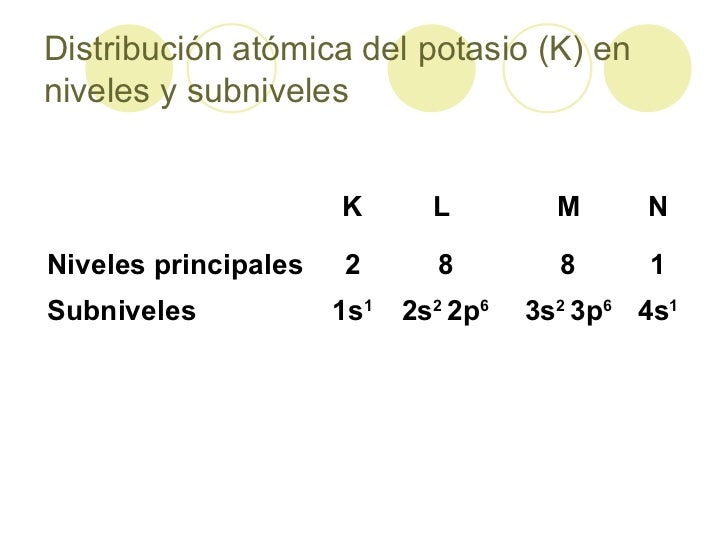
- Potasio: K
- Magnesio: Mg
- Litio: Li
- Arsénico: As
- Bromo: Br
- Cinc: Zn
- Hierro: Fe
- Cloro: Cl
- Estaño: Sn
- Helio: He
También te puedo dar los símbolos químicos y tú encuentras los nombres.
2. Indicar el número de grupo y nombre del grupo en la tabla periódica en cada conjunto de elementos:
a. Fe,Co,NI,
b. Ra, Be, Mg
c. Rn,He,Xe
c. Ga,B,Al
Solución
a. ( VIIIB) Mètalicos
b. (IIA ) Alcalinos-térreos
c. (VIIIA) gases nobles
d. (IIIA) Térreos
ACTIVIDAD
Responde las siguientes preguntas
1.¿Cuál es la función y utilidad de la tabla periódica?
2.¿Qué características comparten los elementos de un mismo grupo y un mismo periodo ?
3.¿Cómo se clasifican los elementos de la tabla periódica?
4.¿Cuáles son los elementos anfóteros y que características presentan?
 6..Escribe en la linea izquierda sólido,líquido,gas a cada uno de los siguientes elementos, y en la línea derecha escribe metal, no metal o metaloide según corresponda :
_________________________ Ca__________________________
_________________________ Cl__________________________
_________________________ Ne__________________________
6..Escribe en la linea izquierda sólido,líquido,gas a cada uno de los siguientes elementos, y en la línea derecha escribe metal, no metal o metaloide según corresponda :
_________________________ Ca__________________________
_________________________ Cl__________________________
_________________________ Ne__________________________
_________________________ Hg__________________________
__________________________K__________________________
_________________________ Br__________________________
_________________________ Sb__________________________
7. Indicar los nombres de los siguientes elementos: busca en la tabla periódica cada símbolo y anota su nombre
a. Mg
b. Ru
c. Tm
d.Se
e. Au
f. Hg
g. K
h. Na
i. Cu
j. Ar
k. Fr
8. Describe la información que aparece en cada recuadro de la tabla periódica, puedes tomar un elemento químico como ejemplo
ENVIAR LAS RESPUESTAS AL CORREO sarrialida4@gmail.com
fecha 24 de mayo-2020
CIBERGRAFIA