LA PRIMERA LEY DE LA TERMODINÁMICA
OBJETIVO : Comprende La primera Ley de la termodinámica relacionando los conceptos
de transferencia de energía, energía térmica y trabajo mecánico.
OBSERVAR EL VÍDEO : https://www.youtube.com/watch?v=FqlyyI9gIV8
https://www.youtube.com/watch?v=dSpyTrpiZmc
https://www.youtube.com/watch?v=dSpyTrpiZmc
La Primera Ley de la Termodinámica la podrás reconocer fácilmente con aquella frase muy famosa que dice “La energía no se crea ni se destruye, solo se transforma”, pues ciertamente la primera ley hace referencia que el calor suministrado a un sistema es igual a la suma del incremento en la energía interna de éste y el trabajo realizado por el sistema sobre sus alrededores.
Esta ley también la podemos encontrar en algunos textos de Física como aquella ley que establece el Principio de Conservación de la Energía y determina que la energía interna de un sistema aumenta cuando se le transfiere calor o se realiza un trabajo sobre él.
La primera ley de la termodinámica la definiremos en conceptos matemáticos para hacerla más entendible.
De lo anterior se deduce:
Dónde;
El signo de 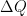 es positivo cuando al sistema se le suministra calor y es negativo si el sistema cede calor.
es positivo cuando al sistema se le suministra calor y es negativo si el sistema cede calor.
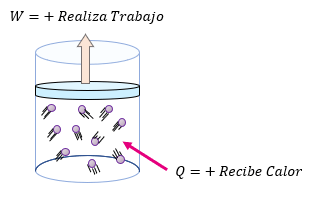
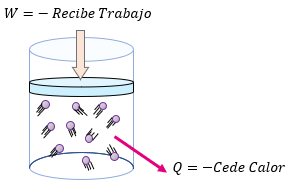
El signo de 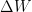 es positivo cuando el sistema realiza trabajo y negativo cuando el trabajo se realiza sobre él.
es positivo cuando el sistema realiza trabajo y negativo cuando el trabajo se realiza sobre él.
Si el sistema incrementa su temperatura el signo  es positivo, y si disminuye su temperatura es negativo.
es positivo, y si disminuye su temperatura es negativo.
Un sistema referido a la termodinámica es el elemento o conjunto particular de elementos que nos interesa podría ser algo tan pequeño como una célula o tan grande como un ecosistema, mientras que todo lo que no está incluido se define como sus alrededores
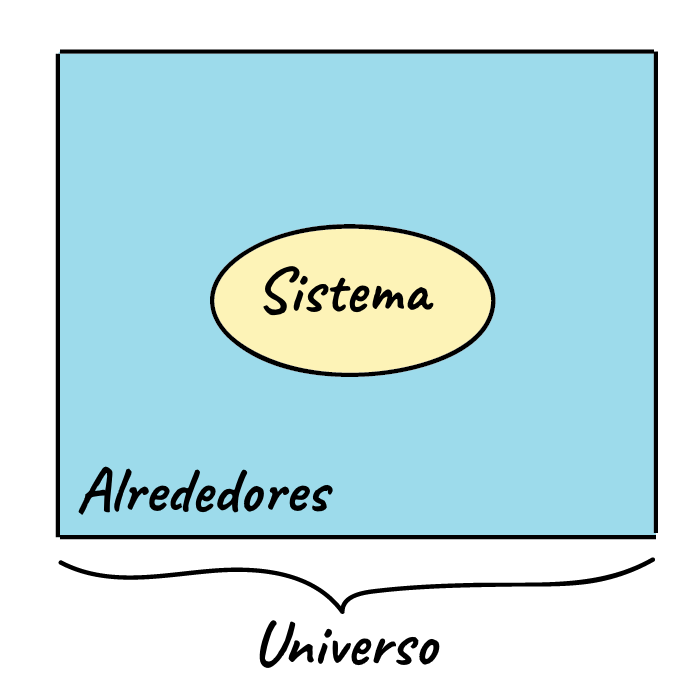
Por ejemplo, si calentaras una olla con agua en la estufa, el sistema podría incluir la estufa, la olla, y el agua, mientras que los alrededores serían todo lo demás: el resto de la cocina, la casa, el vecindario,el país,el planeta, la galaxia y el universo
Hay tres tipos de sistemas en la termodinámica: abierto, cerrado y aislado.
Sistema abierto puede intercambiar energía y materia con su entorno .EJ: el de la estufa sería un sistema abierto, porque se puede perder calor y vapor de agua en el aire al momento de comenzar a hervir el agua.
Sistema cerrado, es por el contrario cuando solo puede intercambiar energía con sus alrededores, no materia. Si ponemos una tapa muy bien ajustada sobre la olla del ejemplo anterior, se aproximaría a un sistema cerrado
Sistema aislado es el no puede intercambiar ni materia ni energía en su entorno.Es difícil encontrarse con un sistema aislado
Esta ley puede parecer algo abstracta, pero si empezamos a ver los ejemplos, encontraremos que las transferencias y transformaciones de energía ocurren a nuestro alrededor todo el tiempo. Por ejemplo:
Los focos transforman energía eléctrica en energía luminosa (energía radiante).
Una bola de billar golpea a otra, lo que transfiere energía cinética y hace que la segunda bola se mueva
las plantas convierten la energía solar ( energía radiante) en energía química almacenada en moléculas orgánicas
Tú estas transformando la energía química de tu última comida en energía cinética cuando caminas, respiras y mueves tu dedo para realizar cualquier actividad de motricidad.
Ejemplos de Primera Ley de Termodinámica
1. En un Globo aerostático, el quemador arroja la llama hacia el aire contenido en el globo. El Calor añadido constantemente hará que el aire sea más ligero y esté más agitado, logrando el Trabajo Mecánico de levantar la canasta por el viento.

2. En un Motor de Combustión interna, se agrega en el pistón un chispazo, que inicia una reacción de combustión. Esta reacción aportará el Calor para que el mismo sistema se expanda, generando un Trabajo Mecánico que permitirá al automóvil un avance.

3.En una Olla de Presión llena de agua, puesta sobre el quemador de una estufa, se generará propiamente una vaporización. El vapor, cada vez más caliente, irá golpeando el interior de la Olla, hasta mover una válvula de liberación que impedirá una potencial explosión.

EJERCICIOS RESUELTOS APLICANDO LA PRIMERA LEY DE LA TERMODINÁMICA
1.calcular el cambio en la energía interna de un sistema en que se realiza un trabajo mecánico W de 800 J y se agrega un calor Q de 3000 J
ΔU = Q – W
ΔU = 3000 J – 800 J
ΔU = 2200 J
2. ¿Cuál será la variación de la energía interna en un sistema que recibe 480 calorías y se le aplica un trabajo de 1090 Joules?
Hemos colocado negativo el trabajo, porque se le está aplicando trabajo al sistema.
Primeramente vamos a convertir las calorías a Joules, haciendo uso de nuestro factor de conversión.
Tenemos nuestra fórmula:
Sustituyendo nuestros datos en la fórmula, obtenemos:
Por lo que la variación de energía interna es de 3106 Joules
3. calcular el cambio en la energía interna de un sistema en que se realiza un trabajo mecánico W de 900 J y se agrega un calor Q de 6000 J
ΔU = Q – W
ΔU = 6000 J – 900 J
ΔU = 5100 J
ACTIVIDAD
Problema 1.- ¿Cuál es el incremento en la energía interna de un sistema si se le suministran 700 calorías de calor y se le aplica un trabajo de 900 Joules?
Problema 2.-A un sistema formado por un gas encerrado en un cilindro como émbolo, se le suministran 600 calorías y realiza un trabajo de 430 Joules. ¿Cuál es la variación de la energía interna del sistema expresado en Joules?
Problema 3.-Empleando la Ecuación de La Primera Ley de termodinámica, calcular el cambio en la Energía Interna de un Sistema en que se realiza un Trabajo Mecánico W de 330 J y se agrega un Calor Q 900 calorías.
Enviar sus respuestas al correo
Fecha 26 de mayo-2020
Fecha 26 de mayo-2020
CIBERGRAFIA
zunigaortegamariafernanda@gmail.com
ResponderEliminarZara Juliana Duque Henker
ResponderEliminarzarajuliduque@gmail.com